近日,Nature Communications在线发表了江南大学未来食品科学中心和生物工程学院陈坚院士团队周景文教授课题组的研究成果“Electron transfer engineering of artificially designed cell factory for complete biosynthesis of steroids”(Chen et al., Nat Commun 16, 3740 (2025))。
甾体等天然产物的生物合成高度依赖电子传递反应(如P450和还原酶催化),其过程始于NADPH等电子供体的再生,经胞内传递组件输送至NADPH依赖酶,最终通过氨基酸残基所组成的电子传递链转移至活性中心。然而,现有合成生物学策略多聚焦于代谢、辅因子和酶工程,常忽视这一多步协同的电子传递机制。
为了解决这一难题,研究团队以甾体类化合物胆固醇和孕烯醇酮的关键合成步骤中C7=C8双键还原及侧链剪切为例,首先利用计算模拟结合突变表征解析了DHCR7的电子传递机制并进一步指导了电子传递工程改造其内部电子传递链,将胆固醇从头合成产量由31 mg/L提升至191 mg/L,且动力学模拟和QM/MM共同证实改造后DHCR7拥有更短和更稳定的电子传递链;随后,筛选得到了Rehmannia glutinosa来源的RgCYP87A3,孕烯醇酮的产量达94 mg/L,并利用QMMM解析其剪切胆固醇侧链进程,发现去质子化和质子耦合电子转移(PCET)具有较高能垒且被认为是限速步骤,进而在催化口袋中引入酸性残基以加速去质子化和PCET进程,孕烯醇酮产量提升至243 mg/L;最后,通过前体代谢途径强化和引入定位线粒体的人源ADR-ADX为ERG25供应电子,进而促使下游甾体代谢产物的空间位置与同定位于线粒体的DHCR7的空间位置重合,调整碳通量流向胆固醇。此外,进一步通过增强NADPH的合成和循环途径,以及连接肽拉近CYP和CPR的物理距离,胆固醇和孕烯醇酮在5 L发酵罐中的最高产量分别达到1.78 g/L和0.83 g/L。
本研究阐明了两种NADPH依赖酶在甾体生物合成中的电子传递机制,并系统设计了从电子再生到最终传递至催化中心的全过程,实现了甾体的高效积累。因此,电子传递工程为构建高效甾体及天然产物合成的细胞工厂提供了一种先进且高效的全新策略。
江南大学2022级博士生陈启航为论文第一作者,周景文教授为论文通讯作者。上述研究工作得到了国家重点研发计划项目(2024YFA0919900)的资助。
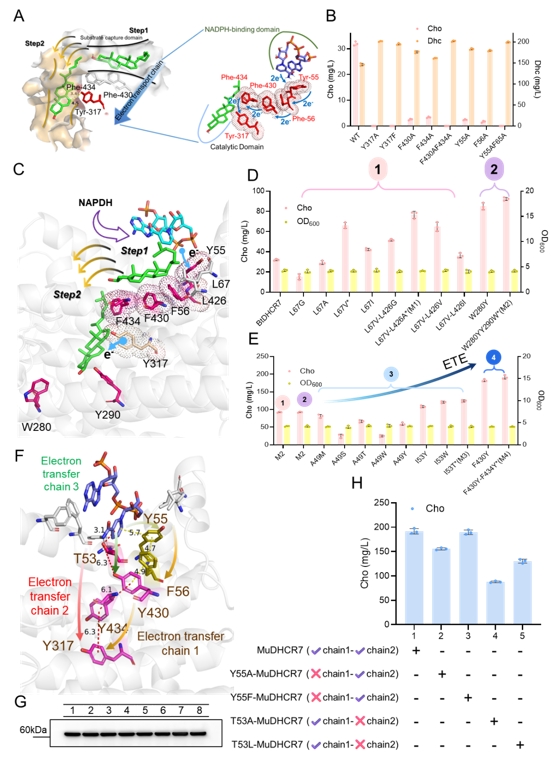
图1 DHCR7的底物捕获域、底物结合域和电子传递链工程
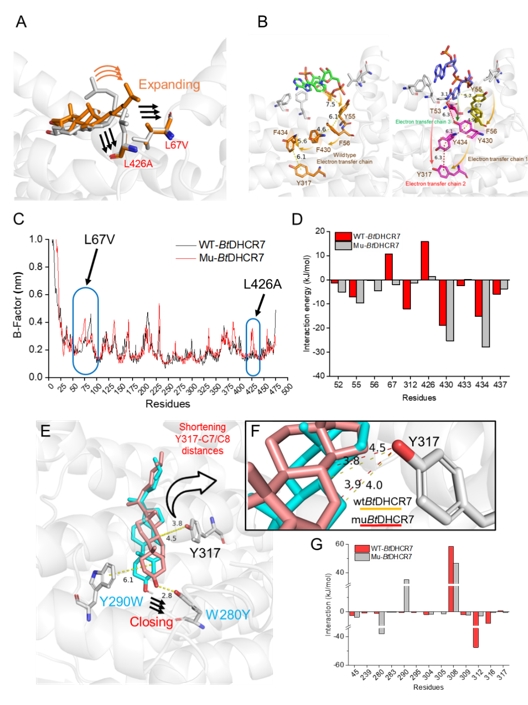
图2 分子动力学模拟解析DHCR7底物捕获域和底物结合域工程机制
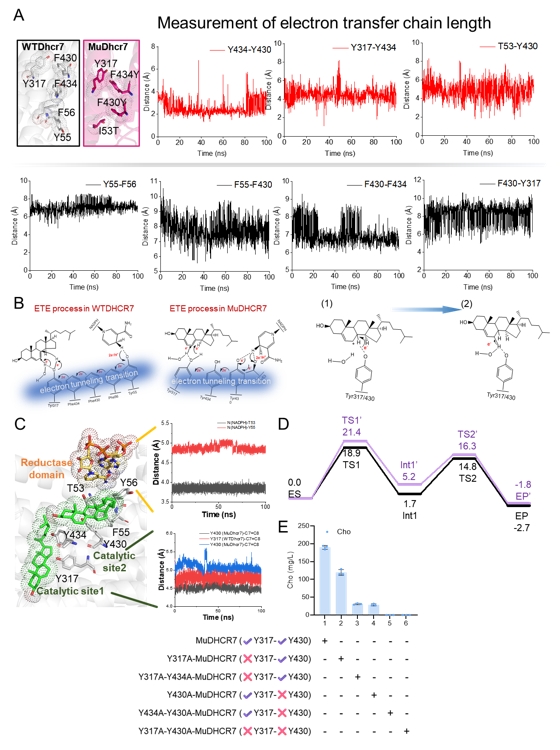
图3 分子动力学模拟和QMMM解析DHCR7电子传递工程机制
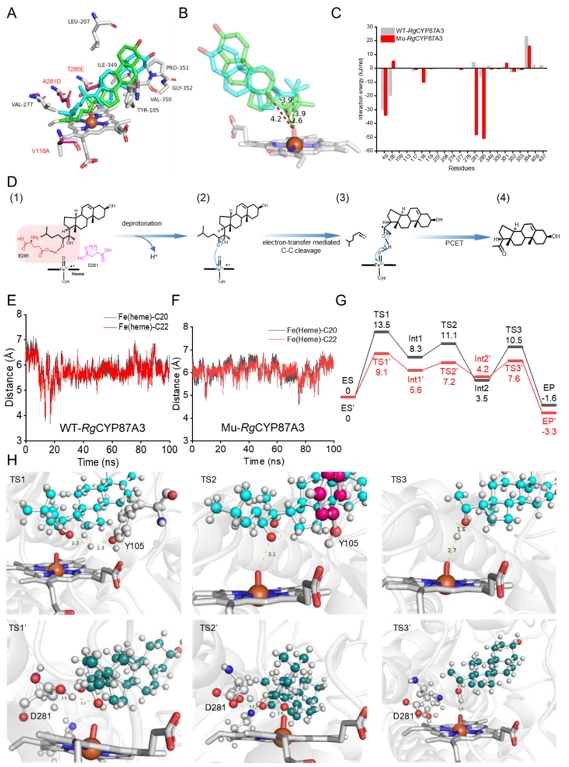
图4 分子动力学模拟和QM/MM解析CYP87A的电子传递工程机制
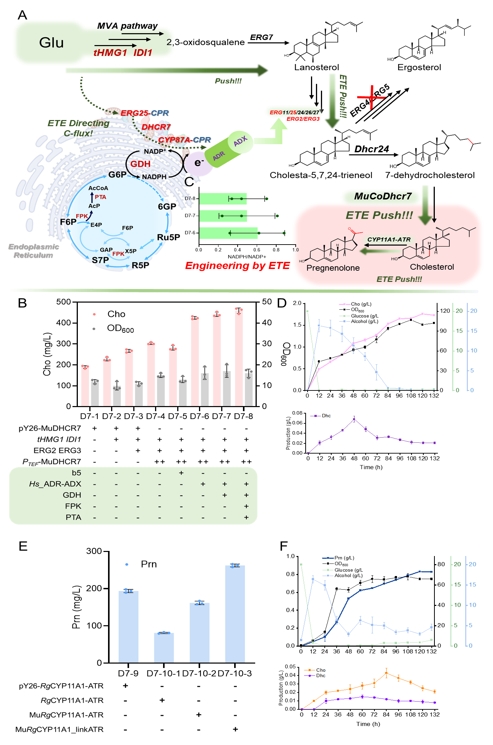
图5 电子传递工程改造细胞工厂高效合成胆固醇和孕烯醇酮

















