近期,我校生物工程学院饶义剑教授团队在“人工光酶设计实现光驱动去消旋化反应”取得了重要进展,研究成果“Light-Driven Deracemization by a Designed Photoenzyme”正式发表于J. Am. Chem. Soc(IF = 14.1) (https://doi.org/10.1021/jacs.4c16521)。
通过设计具有非天然催化活性的酶,为突破传统生物催化的反应限制提供了新策略。该研究基于基因密码子拓展技术成功地将新型蛋白骨架CTB10设计为人工光酶,该酶能够高效催化传统生物催化体系难以实现的热力学不利的环丙烷去消旋化反应。经定向进化后,CTB10光酶展现出广谱的底物适用性和优异的对映选择性(图1)。此外,CTB10光酶-底物复合物的晶体结构清晰地揭示了其手性催化空腔的构效关系,阐明了高效、选择性光驱动去消旋化的结构基础,以上研究为开发具有挑战性的生物催化去消旋化体系提供了新思路。
首先对前期研究解析的尾孢菌素生物合成通路过程中发现的CTB10蛋白结构进行研究 (Angew, 2024; ACS Catal,2022),表明其独特的大疏水口袋和可调节手性空腔为光催化去消旋化提供了理想平台。为此,通过基因密码扩展技术在疏水口袋引入光敏剂BpA(图2c),成功构建了具有多样化催化空腔的小型光酶库,通过筛选发现在W13位插入BpA的M1能够催化具有药用价值的螺环丙烷氧化吲哚去消旋化反应(图2a,b)。
为了提高反应的对映选择性,基于M1的晶体结构进行分子对接分析,并构建突变文库,经过四轮迭代突变重塑手性空腔、改变底物在活性位点附近的构象并微调BpA位置得到最优突变体M4,在温和条件下实现93%的对映选择性(图3),超越了传统化学光催化剂的性能。
随后,对CTB10光酶的底物谱研究发现,与仅限于催化苯环C5位置有取代基的小分子催化剂相比,苯环上不同位置具有不同电子和立体性质的取代基,都能被M4高效去外消旋化。其次,通过关键位点H111的定向进化,显著提高了大位阻底物的对映选择性。此外,NH基团对于小分子光催化剂中底物的定位至关重要,该研究突破性地实现了NH基团修饰底物的高效去消旋。
最后,对M4和M4-(S)-1d的晶体结构及光学实验分析探究反应机制。首先M4能精确识别底物对映体(M4与(S)-1d的结合亲和力(Ksv)显著高于(S)-1d),而底物和BpA与周围氨基酸的多重相互作用使底物定位到距离反应活性位点5.28 Å的位置。随后实现BpA与底物的高效三重态能量转移(量子产率为0.69)。接着,触发(S)-1d开环形成双自由基中间体,该中间体与M4解离后自发环化生成外消旋混合物,其中(S)-对映体重新进入催化循环而(R)-对映体选择性积累,最终实现(R)-对映体的高效富集(图4)。综上所述,通过基因密码扩展技术将CTB10蛋白骨架改造为人工光酶,经定向进化优化后成功实现环丙烷的高效去消旋化,其优异的对映选择性和底物普适性超越了化学光催化方法。晶体结构解析和光学实验揭示了催化机制,证明蛋白质骨架工程化可拓展生物催化的反应范围,为开发新型人工酶提供了通用平台。
江南大学饶义剑教授为论文的通讯作者,博士生李敏、副教授张艳和博士生付楷为共同第一作者,该研究得到了江苏省前沿引领技术基础研究专项、国家自然科学基金项目与中央高校基本科研业务费等项目资助。近年来饶义剑教授团队围绕“天然产物的途径解析和仿生定向合成与应用”开展了系统性的研究,并取得了一系列进展,部分成果已发表在Nature Commun(2023,2024,2025),JACS(2024,2025),Angew(2022, 2023,2024),ACS Catal(2020,2021,2022,2024,2025),Green Chem(2019, 2022),Water Res(2022),J Hazard Mater(2021, 2023),Chem Eng J(2021)等本领域权威期刊。
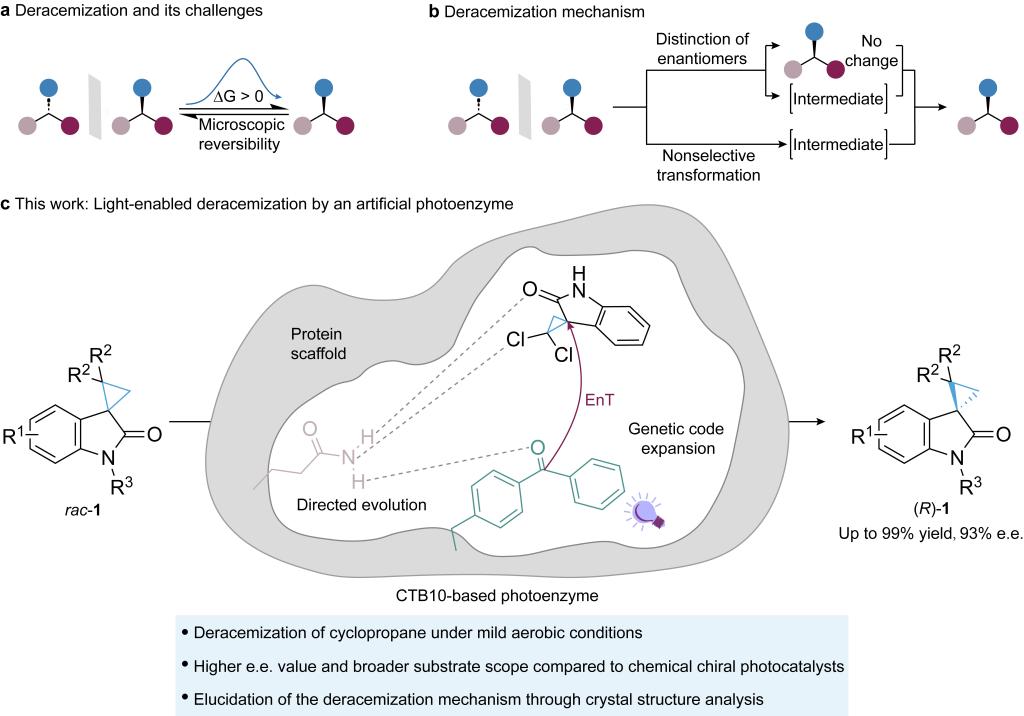
图1 利用去消旋化反应合成单一对映体
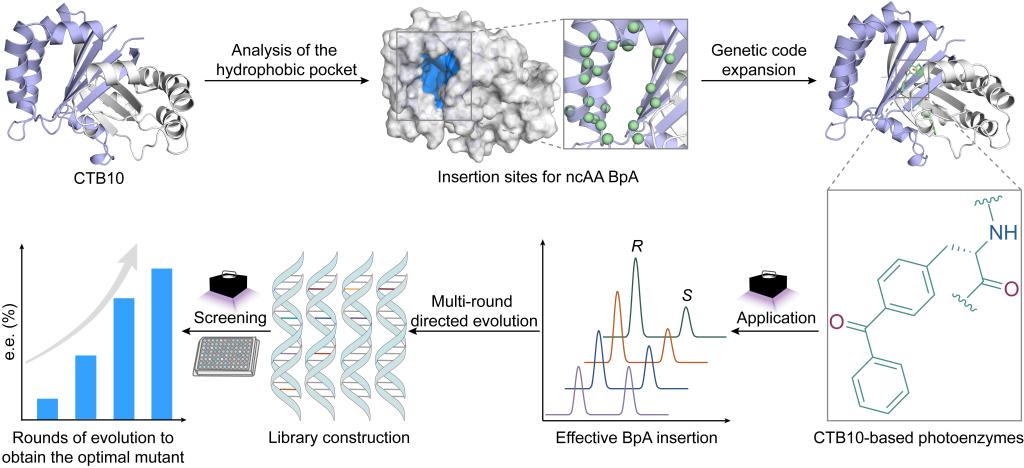
图2 基于CTB10骨架蛋白构建人工光酶用于催化反应
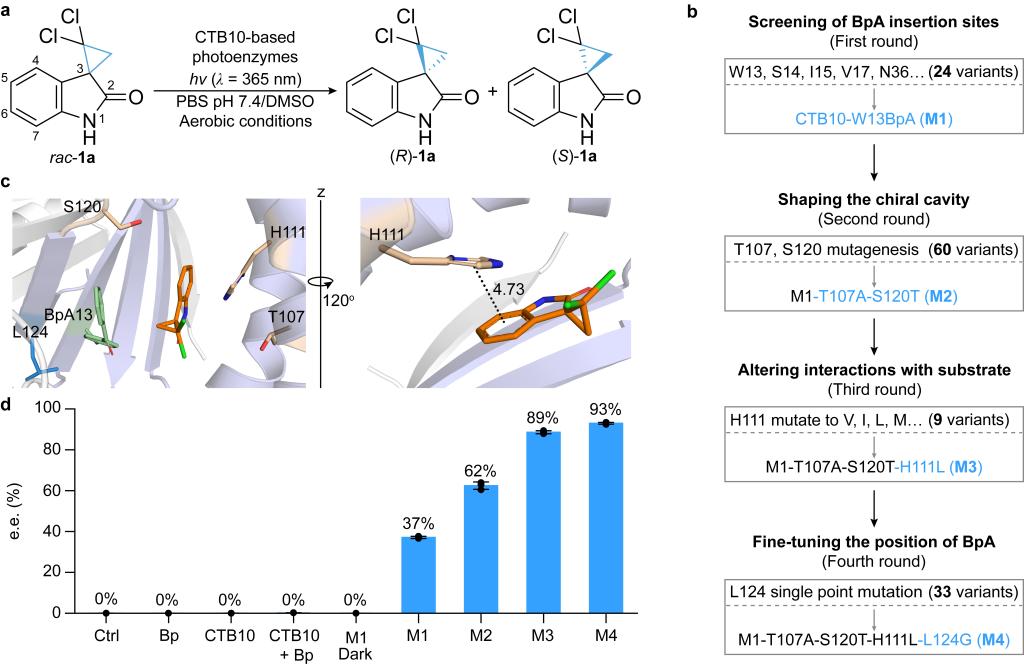
图3 CTB10人工光酶的定向进化

图4 反应机制研究

















