近日我校生物工程学院周哲敏教授团队在L-2-氨基丁酸的生物制备方面取得突破,成功用L-谷氨酸为原料合成L-2-氨基丁酸。研究成果“Enzymatic biosynthesis of L-2-aminobutyric acid by glutamate mutase coupled with L-aspartate-β-decarboxylase using L-glutamate as the sole substrate”发表于《ACS catalysis》(DOI:10.1021/acscatal.0c04141)。
L-2-氨基丁酸(L-ABA)是一种非天然氨基酸,作为一种重要的药物合成中间体,是多种高附加值药物的关键手性切块。由于L-ABA制备成本高,导致相应的药物价格昂贵。L-ABA的化学合成环境污染大,且手性分离十分困难。L-苏氨酸经脱氢、氨化及转氨作用,可三步酶法催化合成L-ABA。但是,该方法过程复杂,需要氨基供体、控制反应平衡及额外的辅酶(NADH)再生系统,并且会产生大量的副产物。这些缺陷使L-2-氨基丁酸的制备成本居高不下。而L-谷氨酸(L-Glu)只需脱去γ位羧基,便可生成L-ABA,因此,L-Glu是生产L-ABA的理想原料。但是,无论是化学催化法还是生物酶法,尚未见L-Glu脱去γ位羧基的报道。
为实现L-Glu中γ位羧基的去除,本研究提出利用谷氨酸变位酶(glutamate mutase,GM)和天冬氨酸β-脱羧酶(L-aspartate-β-decarboxylase,Asd)级联催化L-Glu合成L-ABA的新途径:GM首先将L-Glu转化为L-3-甲基-天冬氨酸(L-3-Met-Asp),再由Asd通过β-脱羧生成L-ABA。虽然GM可以将L-Glu转化成L-3-Met-Asp,然而由于Asd严格的底物选择性特点,无法转化L-3-Met-Asp生成L-ABA。课题组以一种高活性Asd为原始酶,经同源建模及结构分析,首先对底物通道进行改造,获取对L-3-Met-Asp具有催化能力的突变体K18A;在此基础上通过活性中心周围的位点改造,获得了催化活力进一步提升的突变体K18A/V287I。最终,利用GM与Asd的突变体K18A/V287I级联催化,成功实现将L-Glu转化为L-ABA,转化率达到98.9%。本研究成果不仅建立了从L-Glu到L-ABA的酶法合成的新途径,展现了巨大的应用前景,也为非天然氨基酸的酶法合成途径提供了新的思路。
周哲敏教授为该论文的通讯作者,江南大学16级博士生刘宇锋和20级博士后韩来闯为该论文的共同第一作者。上述研究工作得到了国际科技合作创新重点项目(2017YFE0129600)、国家自然科学基金(21878125)、江苏省自然科学基金(BK20181206)等项目的资助。
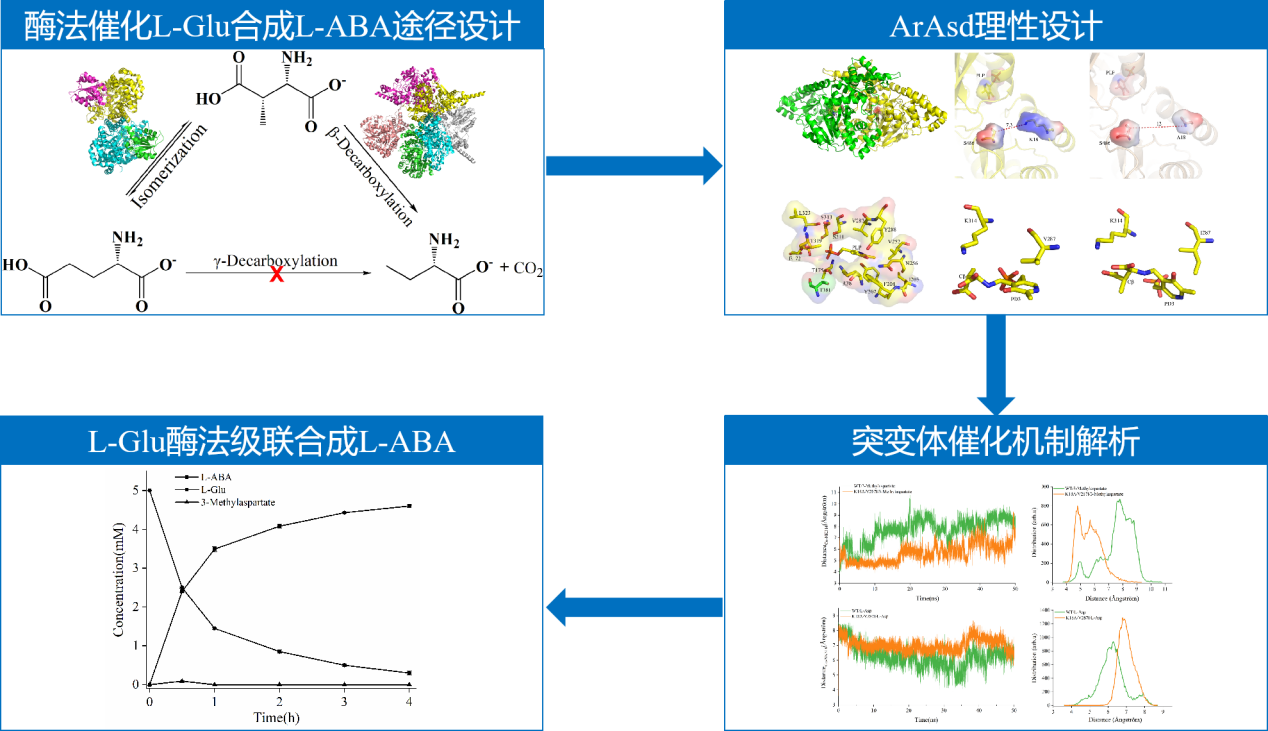
酶法催化L-谷氨酸合成L-2-氨基丁酸的理性设计

















