江南大学陆文伟教授团队的最新研究表明,肠道里的“有益菌”嗜黏蛋白阿克曼菌(A. muciniphila)及其产生的关键代谢物N-乙酰亚精胺能够增强肠道上皮细胞的α1,2-岩藻糖基化过程,为肠道构建了更坚固的“保护屏障”。该研究不仅明确了A. muciniphila代谢物对肠道糖基化的调控作用,更为炎症性肠病的生物治疗提供了新的思路,对推动通过肠道菌群维护人体肠道健康具有重要意义。相关研究成果以“Akkermansia muciniphila-Derived N-Acetylspermidine Modulates the Localization of Intestinal α1,2 -Fucosylated Proteins to Maintain Gut Homeostasis” 为题,于2025年8月7日在线发表于Advanced Science期刊。
炎症性肠病(IBD)是一种以黏膜炎症和糖基化紊乱为特征的慢性复发性疾病,发病率持续上升。肠上皮的糖基化状态对维持菌群与宿主的稳态至关重要,已有研究表明,FUT8 介导的 α1,6-岩藻糖基化加重炎症,而 FUT2 介导的 α1,2-岩藻糖基化则具有保护作用。该研究发现,人体肠道中的一种黏液定植共生菌——A. muciniphila,能够通过代谢精氨酸产生N-乙酰亚精胺,调节肠道岩藻糖基化,从而发挥其对结肠炎的保护作用。
研究团队首先通过动物实验发现,A. muciniphila 可显著上调结肠组织中的 α1,2-岩藻糖基化水平,改善肠道屏障功能,降低炎症相关因子表达。通过多组学整合分析,研究鉴定出 A. muciniphila 的一种关键代谢产物——N-乙酰亚精胺,其可通过HDAC2-C1GALT1C1轴上调α1,2-岩藻糖基化。
机制研究表明,N-乙酰亚精胺可通过抑制PIM1激酶,解除对HDAC2的负调控作用,进而上调C1GALT1C1基因的表达,C1GALT1C1是合成O-糖基核心结构的重要酶,参与α1,2-岩藻糖基化的底物生成。增强的α1,2-岩藻糖基化促进了肠道屏障关键成分ZO-1和ZO-2的膜定位,同时抑制了与炎症相关的因子C3的分泌,从而维持肠道稳态并缓解结肠炎。
该工作第一通讯单位为江南大学食品科学与资源挖掘全国重点实验室、食品学院。食品学院博士研究生姚叶、博士后裴彰明为共同第一作者,通讯作者为陆文伟教授。本研究工作得到了国家重点研发计划项目、国家自然科学基金重大项目、江南大学“至善青年学者”项目资助。
论文链接:https://doi.org/10.1002/advs.202506576
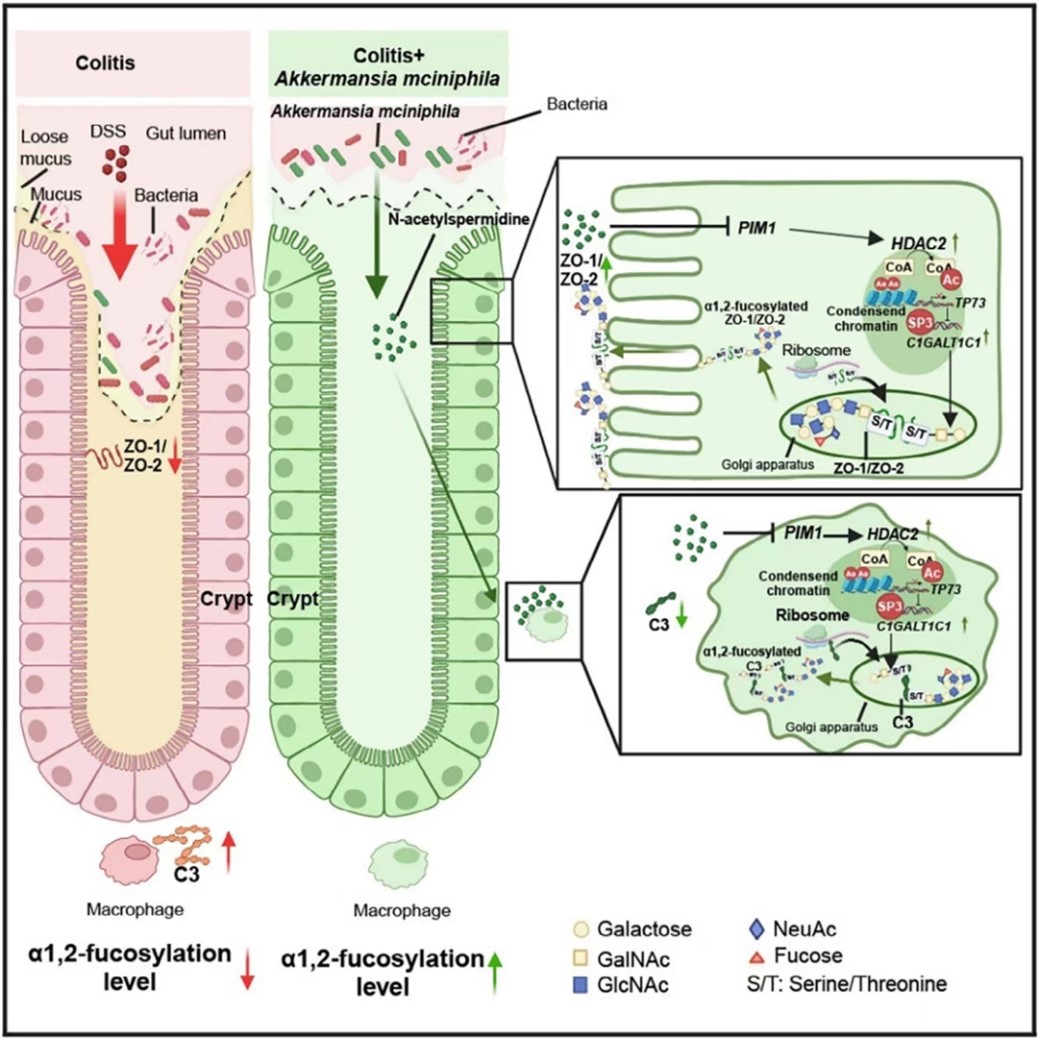
图1:A. muciniphila调节肠上皮 α1,2-岩藻糖基化维持肠道稳态机制示意图
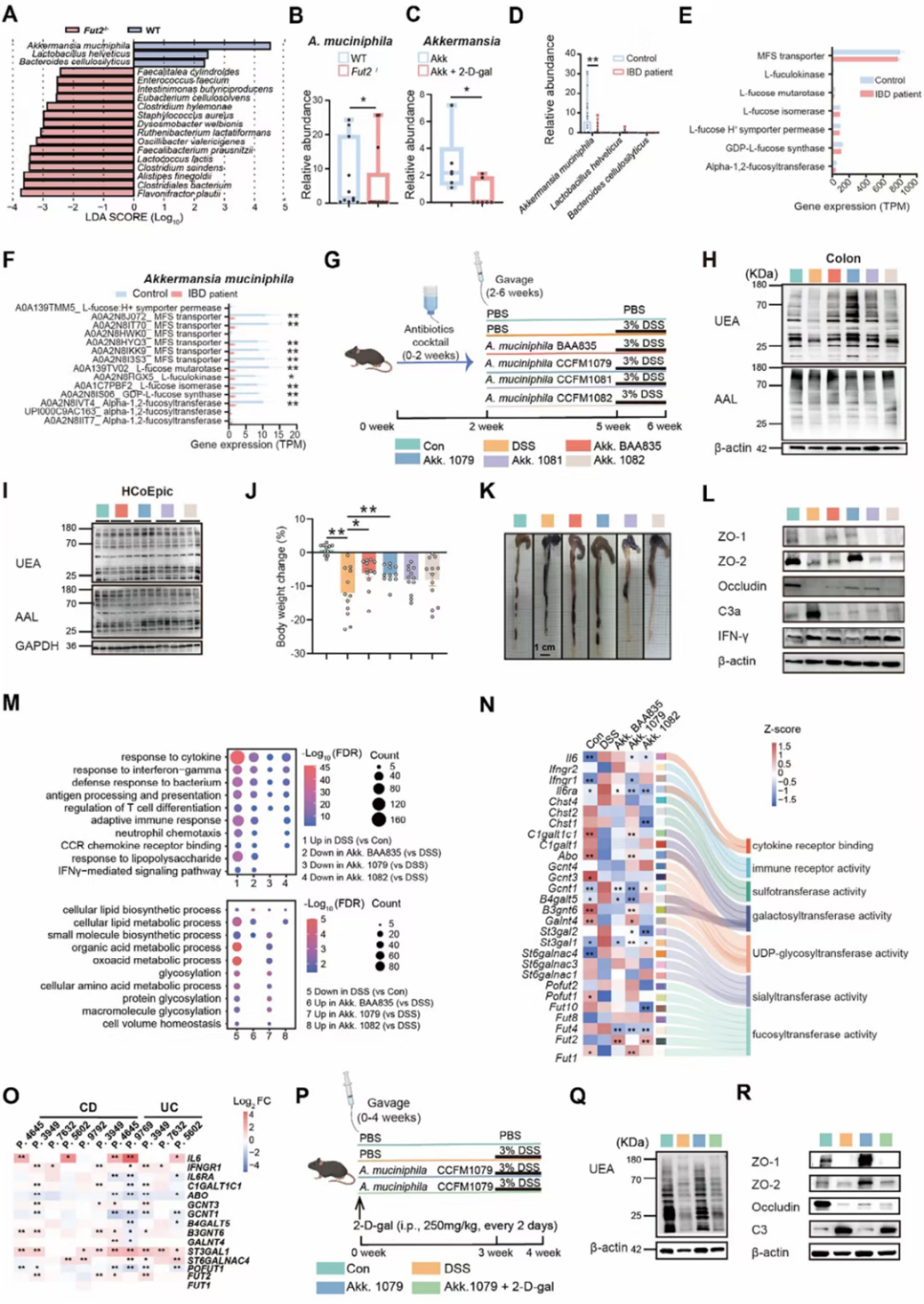
图2:A. muciniphila调节肠道α1,2-岩藻糖基化缓解结肠炎
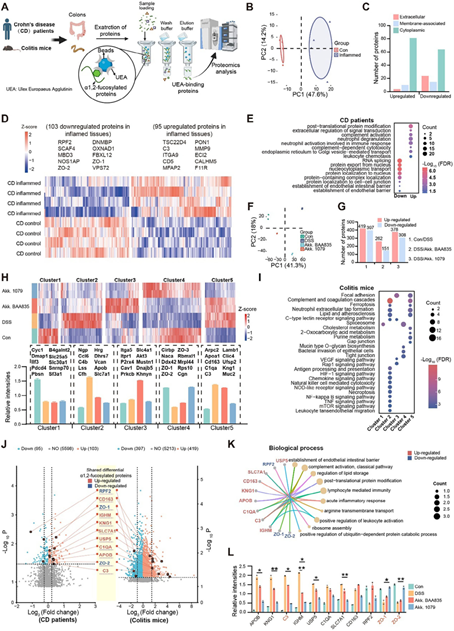
图3:A. muciniphila调节IBD相关α1,2-岩藻糖基化蛋白表达模式的改变
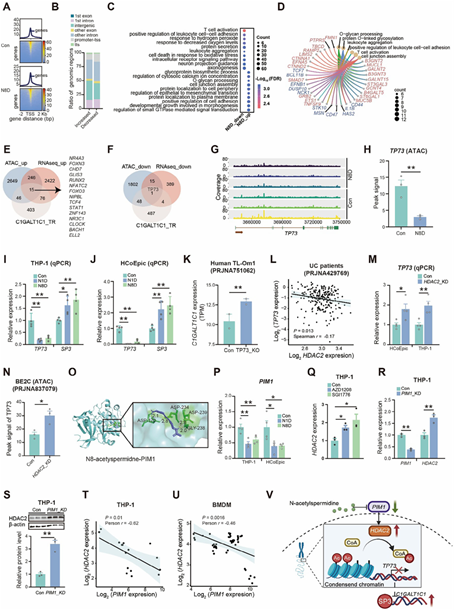
图4:N-乙酰亚精胺通过增加C1GALT1C1表达缓解结肠炎











