近期,未来食品科学中心陈坚院士团队康振教授课题组在RNA调控元件与正交调控系统设计开发方面取得重要进展,研究成果“Design of orthogonal and portable RNA devices for post-transcriptional regulation by reverse engineering type I toxin-antitoxin systems”正式发表于Nucleic acids Research (IF = 13.1) 。
I型毒素-抗毒素(TA)系统是细菌基因组中广泛存在的转录后调控模块,其常见的工作机制是依靠小RNA抗毒素与毒素mRNA配对形成空间位阻干扰毒素蛋白的翻译,或形成RNA双链后被特定核酸酶识别并加速毒素mRNA降解。因其调控机制具有动态可逆、响应迅速和模块性强等特点,故可被改造成为一类转录后调控的人工RNA元件。但天然I型TA系统的功能发挥往往依赖特定宿主背景体系,导致现有的此类元件标准化程度低。同时已报道的I型TA系统数量有限且构效关系复杂进一步限制了其可设计的序列空间,导致元件之间工作容易发生非特异配对与串扰,难以支撑基因电路的复杂调控。
为此,康振教授团队在机制层面对I型TA系统进行逆向工程,从已报道的I型TA数据集中整理配对特征,并选取枯草芽孢杆菌中的I型抗毒素小RNA作为研究对象,分析挖掘其基于RNase III介导降解所需的核心模体与结构要素,并在此基础上引入Toehold switch等模体封装模块,实现了人工RNA调控元件SRTS-OPRTS的从头设计。通过额外设置非同源配对能量约束实现了批量输出彼此低串扰的正交元件文库,相关自动化设计方案已部署到在线平台(www.kangzlab.cn/SR-OPR)。该研究中人工从头设计构建的SRTS-OPRTS正交调控系统具有轻量化和即插即用的特性,可以在枯草芽孢杆菌、大肠杆菌以及谷氨酸棒杆菌等常用宿主中应用。通过将SRTS与OPRTS分别作为标签嵌入两路不同表达模块中,可以构建彼此互相抑制的动态开关,从而实现实时响应外界变化的动态调控系统。同时,采用SRTS和OPRTS分别标记目的基因与毒素基因,可以快速建立生长偶联型的高通量筛选平台,通过调整毒素基因的表达强度来选择性富集目的基因突变文库中的高转录活性突变体。综上所述,本研究提出了一种SRTS-OPRTS非编码RNA转录后调控系统的标准化设计管线,为轻量级合成生物学正交元件库以及调控系统的设计、构建以及合成代谢途径的动态调控提供了新的工具箱。
康振教授和胥睿睿博士为论文的共同通讯作者,我校2022级博士生尹国斌为第一作者。上述研究得到了国家重点研发计划(2024YFF1106300)、国家自然科学基金联合基金项目(U24A20368)等资助。
近年来康振教授团队在基因表达调控体系构建以及糖胺聚糖细胞工厂设计构建优化以及产业化方面取得丰硕成果,相关研究成果已发表在Nature Communication (2025, 2023, 2020)、ACS Catalysis (2021)、Nucleic acids Research (2025)、Chemical Engineering Journal (2025)、Carbohydrate Polymers (2024, 2024, 2022, 2022, 2020, 2020)、Green Chemistry (2022、2021)等本领域权威期刊。
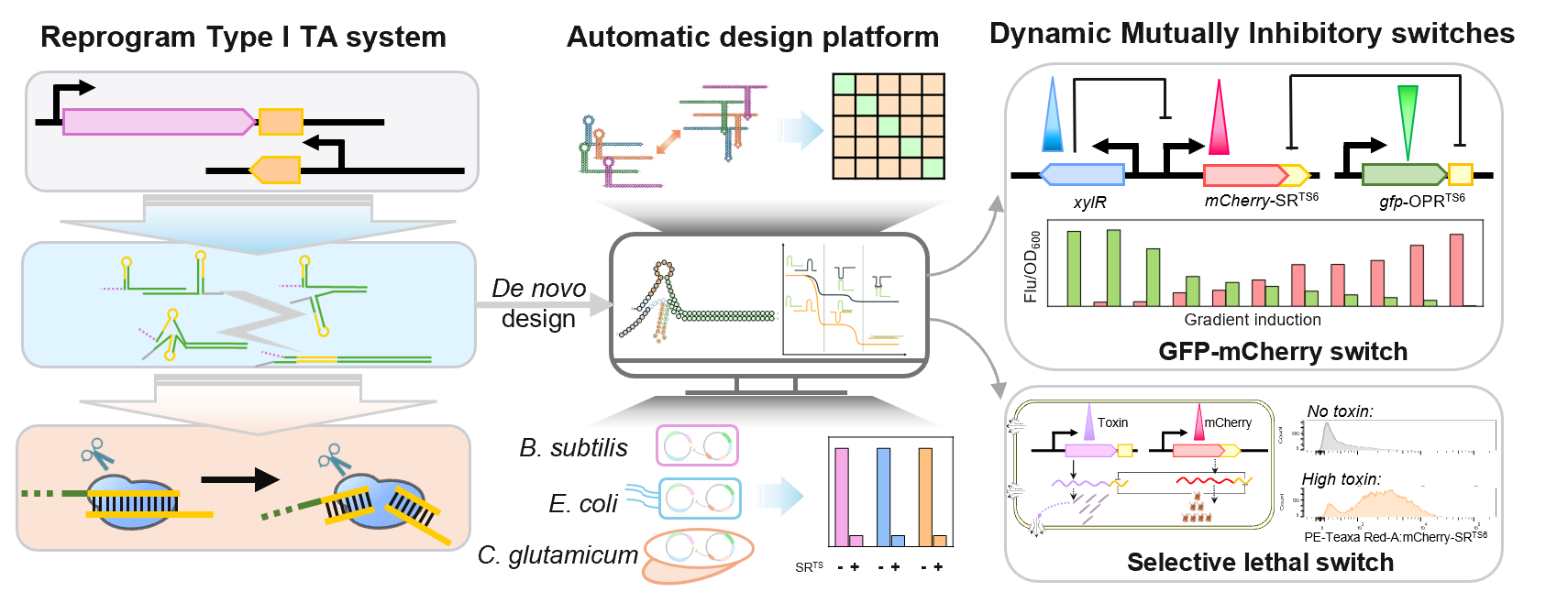
图形摘要











